天网恢恢,疏而不漏——用微流体技术检测癌细胞
徐江
加拿大多伦多St. Michael’s Hospital李嘉诚医学中心
关键词:微流体、癌症检测、细胞筛
引子
癌症因为无限增殖、极易变异、发生转移这三大特点使得都对它闻风色变。晚期的癌症往往伴随着全身的严重并发症,让病人备受折磨,现代医学治疗也往往束手无策。然而,早期癌症的治疗、控制却相对地容易得多,如果能早期发现并及时治疗,可以极大地提高病人的5-10年生存率乃至彻底治愈。
但是怎样及早地发现早期癌症却是个令人头疼的问题,电视剧或者电影里我们可以常常看见医生在显微镜下观察患者的病理切片,实际上这些镜头并不算夸张。就目前医学研究而言,想最终100%肯定地确诊癌症,只有靠病理诊断,就是想办法取得肿瘤组织后做切片观察,比如直肠镜/宫腔镜取活检。这些技术耗时很久,而且不可避免地要侵入患者体内取样、观察,而且对于痕量的早期癌症症状有较大的判断误差。那么,有没有什么办法可以快速、微创,而且准确地检测出早期癌症呢?
办法是有的。前面我们说过,癌症细胞的一大“恶习”就是特别容易转移,这是因为它们表面的一些特殊蛋白质也使得它们比正常细胞更容易发生移动[1],顺着人体内的淋巴、组织液、血液发生迁移,这也就是癌症研究中常说的体内游离癌细胞(CTCs,circulating tumor cells)。CTCs被认为是肿瘤发生转移的必要前提因此,也就是说检测到了CTCs,就知道病人患上了癌症。
可是新的问题又来了,CTCs容不容易检测到呢?对于传统医学来说这很难:虽然普通癌细胞的尺寸(14~26微米)要比正常的红细胞(6~9微米)和白细胞(8~20微米)要大,而且具有显著的形貌特征[2],但是CTC在人体血液中的数量非常少,约109 个血细胞中仅含有1~10 个CTCs。如此低的数量,靠常规的离心、抗体抗原反应、显微镜观察都是无法检测出的,成功几率极低。那我们还没有别的什么高灵敏度的手段可以用了呢?答案是—“有!”,这就是今天我们要介绍给大家的用于早期癌症检测的微流体技术。
微流体技术简介
微流体技术是一种微观尺寸下控制、操作和检测复杂流体的技术,发展形成于上世纪90年代初,是一门结合了物理、化学、生物、医学、工程制造等领域的交叉学科。顾名思义,“微”指的是尺寸小、精度高,可以精确地观测和操控几微米到几百微米的流体,“流体”是我们观测和操控的对象,可以是溶液,血液,气体,甚至是超临界流体。现代的微流体技术可以在几平方厘米的玻璃或者塑料芯片基底上集成数百乃至上万的功能单元,通过简单的实验设计,研究人员可以操作数个到数亿个微小尺度的小液滴、小气泡、生物细胞等基本单位,如图一。

图一:一块用于血液分析检测的聚合物基微流体芯片(来源:美国Brigham Young University)
微流体“细胞筛子”
首先我们需要制备出一块小型的微流体芯片,这块芯片是由一种高分子材料聚二甲基硅氧烷(PDMS)构成(参考图一),安全无害,而且可以反复使用。癌细胞和正常细胞混杂在一起进入整个微流体管道,管道的另一端形似筛子,比正常血细胞的尺寸要大一些,比癌细胞的尺寸要小一些,起到“过滤器”的作用。当癌细胞和正常细胞一起流过过滤器的时候,癌细胞会被挡在外面,红细胞和大部分白细胞可以自由穿过,而少部分较大的白细胞因为自身柔软容易变形,也可以在适当的加压下穿过过滤器,这样最先被筛选出来的样品就都是血液中的极少数大型细胞,再通过显微镜观查等常规方法就可确认血液中是否含有CTC了(参考图二)。
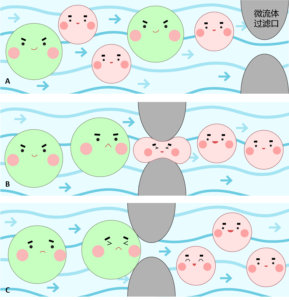
图二:(A)癌细胞(绿色)和血细胞(红色)一起在微流体管道中被过滤;(B)血细胞可以正常通过过滤管道;(C)癌细胞无法穿过过滤管道。插图作者:罗楠-UX designer, Finastra, Toronto
这种微流体检测技术所需要的血液样本极少,数百微升即可完成一次生化分析检测,而且灵敏度非常高,可以将混在1 mL血液中掺入的10 个肿瘤细胞在15 min 内完全捕获,准确率可以达到97%[3])。

图三: 阵列式微流体过滤通道图示。RBC(红细胞),WBC(白细胞),CTC(游离癌细胞)会被分离进入不同管道出口,收集分析 [4]。
总结
这种方法简单快速,高效便捷,在微流体的“天网”下,血液中的极少量的游离癌细胞也无从隐藏,被我们快速地一一捕获分析,这也正是微流体技术相比传统检测技术的优势所在。。目前有很多的医药公司和研究机构都在大力地推进这一技术的批量产业化应用,微流体检测技术正在迅速地渗透到并帮助着癌症研究和治疗的方方面面,在不远的将来,我们会从中受益更多。当然我们希望大家还是要健康饮食,积极锻炼,什么癌症都不要有哦~~的风格。
*本文仅代表作者个人观点,不代表本网站观点;如其他媒体、网站或个人从本网站转载使用,需注明文章来源,并自负版权等法律责任;作者如不希望被转载或者联系转载稿费等事宜,请与我们联系。
参考文献:
[1] Balic M, Williams A, Lin H, et al. Circulating tumor cells: from bench to bedside. Annu Rev Med, 2013, 64: 31-44
[2] Gorges T M, Tinhofer I, Drosch M, et al. Circulating tumour cells escape from EpCAM-based detection due to epithelial-tomesenchymal transition. BMC Cancer, 2012, 12(1): 178
[3] Hosokawa M, Kenmotsu H, Koh Y, et al. Size-based isolation of circulating tumor cells in lung cancer patients using a microcavity array system. PloS One, 2013, 8(6): e67466
[4] Tilman Todenhöfer et al.,Urologic Oncology,Volume 34, Issue 11, Pages 483.e9–483.e16
Post Reviews:
No reviews yet...









