纳米酶的发展与应用
张子杰
加拿大滑铁卢大学化学系
关键词:纳米酶,模拟酶,纳米材料
谈到酶(Enzyme),人们最先想到的可能是蛋白质,核酸等具有催化作用的生物活性物质。1926年, 生化学家James B. Sumner博士发现了第一个酶(尿素酶),并证实其为蛋白质分子[1]。自此之后,蛋白质一直被认定为是所有酶的物质构成,直至1982年核酸酶类被发现[2]。然而,这些由生物活性物质组成天然酶类在生物体内的含量很低,很难大量获得,因此价格昂贵。而且天然酶类的稳定性很差,pH值或温度的变化都会使蛋白酶失去活性。为了突破这些限制,稳定而可低成本合成的人工模拟酶的研究与开发日益受到人们的关注。纳米酶就是其中重要的一类。
随着纳米科学的高速发展,一些无机纳米材料被发现具有类似酶的催化活性。这些纳米材料可以催化天然酶的底物反应,并且具有与天然酶相似的催化机制,因此被定义为纳米酶(Nanozymes) [3]。1997年,一种富勒烯衍生物被发现具有过氧化物歧化酶的活性,成为首个被发现的无机纳米酶[4]。时至今日,已有超过50多种的无机纳米材料被发现具有不同的催化活性,比如二氧化铈纳米粒和铁磁纳米粒具有过氧化物酶活性,金纳米粒具有氧化酶活性,硫化镉和硒化镉纳米粒具有硝酸还原酶活性等等[5]。纳米酶的最突出特点是其具有较高的催化活性,这是其他模拟酶无法比的。此外,纳米酶自身作为一种无机材料,还具有独特的理化特性。人们可以利用成熟的纳米技术对纳米材料进行尺寸控制和表面修饰从而对其酶活性进行调节。纳米酶的发现打破了以往人们认为无机纳米材料是一种生物惰性物质的观念,揭示了无机纳米材料也具有生物活性的一面(见图一)。
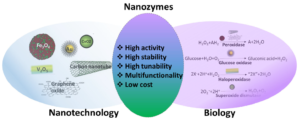
图一:纳米酶特性与催化作用[5]。
纳米酶的出现不仅改变了人们对酶的认识,更提供了广阔的应用价值。首先,纳米酶的出现为肿瘤诊断提供了新的方法。比如将磁性纳米粒子与抗体偶联可特异性地识别肿瘤细胞。微量的磁性纳米粒催化产生的自由基亦可杀死癌细胞[6]。近期,研究者将葡萄糖氧化酶固定到具有过氧化物酶活性的四氧化三铁纳米酶表面进行催化显色反应来检测葡萄糖的含量[7]。这一方法不仅简单,而且快速可靠。此外,利用纳米酶建立的酶联免疫法可以大幅提高检测的灵敏度。纳米酶还被广泛地作为药物载体用于疾病的靶向治疗[8]。不久的将来,纳米酶将会为人类的健康,能源的再生及环境的保护等做出更多贡献。
*本文仅代表作者个人观点,不代表本网站观点;如其他媒体、网站或个人从本网站转载使用,需注明文章来源,并自负版权等法律责任;作者如不希望被转载或者联系转载稿费等事宜,请与我们联系。
参考文献:
[1] Sumner, J. B. The isolation and crystallization of the enzyme urease preliminary paper. J. Biol. Chem. 1962, 69(2): 435-441.
[2] Cate, J. H., et al. Crystal structure of a group I ribozyme domain: principles of RNA packing. Science 1996, 273 (5282): 1678-1685.
[3] Wei, H.; Wang, E. Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes. Chem. Soc. Rev. 2013, 42(14): 6060-6093.
[4] Dugan, L., et al. Carboxyfullerenes as neuroprotective agents. Proc. Natl. Acad. Sci. U.S.A. 1997, 94(17): 9434-9439.
[5] Gao, L.; Yan. X. Nanozymes: an emerging field bridging nanotechnology and biology. Sci. China. Life Sci. 2016, 59(40): 400.
[6] Fan, K., et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues. Nat. Nanotechnol. 2012, 7(7): 459-464.
[7] Jiang X., et al. Peroxidase-like activity of apoferritin paired gold clusters for glucose detection. Biosens. Bioelectron. 2015, 15(64):165-70.
[8] Ambrosi, A., et al. Enhanced gold nanoparticle based ELISA for a breast cancer biomarker. Anal. Chem. 2009, 82(3): 1151-1156.
Post Reviews:
No reviews yet...









